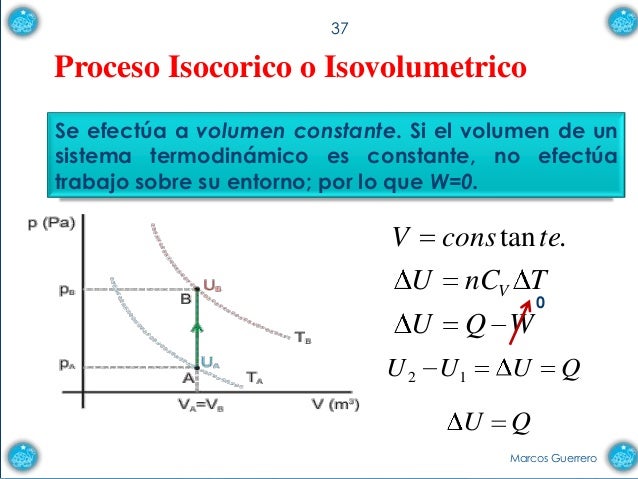
Un proceso isocórico, también llamado proceso isométrico o isovolumétrico es un proceso termodinámico en el cual el volumen permanece constante; ΔV = 0. Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como:
ΔW = PΔV,
donde P es la presión (el trabajo es positivo, ya que es ejercido por el sistema).
Aplicando la primera ley de la termodinámica, podemos deducir que Q, el cambio de la energía interna del sistema es:
Q = ΔU
para un proceso isocórico: es decir, todo el calor que transfiramos al sistema quedará a su energía interna, U. Si la cantidad de gas permanece constante, entonces el incremento de energía será proporcional al incremento de temperatura,
Q = nCVΔT
donde CV es el calor específico molar a volumen constante.
PROCESO ADIABATICO
Un proceso adiabático es aquel en que el sistema no pierde ni gana calor. La primera ley de Termidinámica con Q=0 muestra que todos los cambios en la energía interna estan en forma de trabajo realizado. Esto pone una limitación al proceso del motor termico que le lleva a la condición adiabática mostrada abajo. Esta condición se puede usar para derivar expresiones del trabajo realizado durante un proceso adiabático.
Es un proceso termodinámico, que se produce sin intercambio de calor con el exterior:
Que no permite el intercambio de calor, que está aislado térmicamente, que está totalmente aislado del exterior.El término adiabático hace referencia a elementos que impiden la transferencia de calor con el entorno. Una pared aislada se aproxima bastante a un límite adiabático. Otro ejemplo es la temperatura adiabática de llama, que es la temperatura que podría alcanzar una llama si no hubiera pérdida de calor hacia el entorno. En climatización los procesos de humectación (aporte de vapor de agua) son adiabáticos, puesto que no hay transferencia de calor, a pesar que se consiga variar la temperatura del aire y su humedad relativa.
El calentamiento y enfriamiento adiabático son procesos que comúnmente ocurren debido al cambio en la presión de un gas. Esto puede ser cuantificado usando la ley de los gases ideales.

PROCESO DIATÉRMICO
Un proceso diatérmico es aquel cuerpo que deja pasar fácilmente calor.
Una interacción térmica es cualquier otro tipo de intercambio de energía. En este caso la pared se denomina diatérmica, diatérmico también puede entenderse por isotérmico , significa que no hay cambio de temperatura debido a una pared diatérmica que aísla el sistema del medio ambiente, en cuanto diatérmicos se refieren a que el sistema tiene un intercambio de energía con los alrededores, un ejemplo, nosotros, los seres humanos, somos sistemas diatérmicos, ya que estamos intercambiando energía con nuestro ambiente, una pared diatérmica es aquella que permite la transferencia de energía térmica (calor) pero, sin que haya transferencia de masa, cualquier superficie real es una superficie diatérmica, por ejemplo, un vaso, los muros de una casa, etc., todos en mayor o menor grado permiten la transferencia de calor.
Límite diatérmico:
Se dice que un límite es diatérmico cuando permite que el estado del sistema se modifique sin que haya movimiento del límite. La manera usual de definirlo es que un límite es diatérmico cuando permite el flujo de calor a través de él
Paredes diatérmicas:
Son aquellas que sí permiten que un sistema termodinámico modifique su grado relativo de calentamiento.

No hay comentarios.:
Publicar un comentario